Hidrocarburo alifático
Los hidrocarburos alifáticos son compuestos orgánicos constituidos por carbonoe hidrógeno cuyo carácter no es aromático.
Los compuestos alifáticos acíclicos más sencillos son los alcanos, agrupaciones hidrocarbonadas lineales de fórmula CH3-(CH2)n-CH3.
Si la cadena alifática se cierra formando un anillo, el compuesto se denomina hidrocarburo alicíclico o hidrocarburo alifático cíclico. De estos, los más sencillos son los cicloalcanos.
Usos
Para el estudio y evaluación del método analítico, se ha considerado como compuestos representativos de esta familia orgánica n-hexano, n-heptano, n-octano y n-nonano. Sin embargo, este método de análisis puede aplicarse a compuestos de la misma familia como por ejemplo n-pentano, n-decano, etc.
El método "Determinación de hidrocarburos alifáticos (n-hexano, n-heptano, n-octano, n-nonano) en aire - Método de adsorción en carbón activo/Cromatografía de gases", es un método aceptado por el Instituto Nacional de Seguridad e Higiene en el Trabajo español (INSHT). Como método aceptado se entiende un método utilizado en el INSHT y que ha sido sometido a un protocolo de validación por organizaciones oficiales competentes en el área de la normalización de métodos analítico, o bien ha sido adoptado como método recomendado por asociaciones profesionales dedicadas al estudio y evaluación de riesgos por agentes químicos, así como, aquellos métodos recomendados por la CE o basados en métodos ampliamente conocidos y evaluados por especialistas en este tipo de análisis de la reacción.
Hidrocarburo aromático
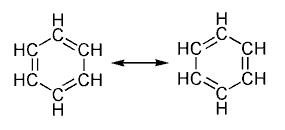
Un hidrocarburo aromático o areno1 es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π.2 Para determinar esta característica se aplica la regla de Hückel (debe tener un total de 4n+2 electrones π en el anillo) en consideración de la topología de superposición de orbitales de los estados de transición.2 Para que se dé laaromaticidad, deben cumplirse ciertas premisas, por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y que se den al menos dos formasresonantes equivalentes. La estabilidad excepcional de estos compuestos y la explicación de la regla de Hückel han sido explicados cuánticamente, mediante el modelo de "partícula en un anillo".
Originalmente el término estaba restringido a un producto del alquitrán mineral, elbenceno, y a sus derivados, pero en la actualidad incluye casi la mitad de todos los compuestos orgánicos; el resto son los llamados compuestos alifáticos. El exponente emblemático de la familia de los hidrocarburos aromáticos es el benceno (C6H6), pero existen otros ejemplos, como la familia de anulenos, hidrocarburos monocíclicos totalmente conjugados de fórmula general (CH)n.
Estructura
Una característica de los hidrocarburos aromáticos como el benceno, anteriormente mencionada, es la coplanaridad del anillo o la también llamada resonancia, debida a la estructura electrónica de la molécula. Al dibujar el anillo del benceno se le ponen tres enlaces dobles y tres enlaces simples. Dentro del anillo no existen en realidad dobles enlaces conjugados resonantes, sino que la molécula es una mezcla simultánea de todas las estructuras, que contribuyen por igual a la estructura electrónica. En el benceno, por ejemplo, la distancia interatómica C-C está entre la de un enlace σ (sigma) simple y la de uno π(pi) (doble).
Todos los derivados del benceno, siempre que se mantenga intacto el anillo, se consideran aromáticos. La aromaticidad puede incluso extenderse a sistemas policíclicos, como el naftaleno,antraceno, fenantreno y otros más complejos, incluso ciertos cationes y aniones, como el pentadienilo, que poseen el número adecuado de electrones π y que además son capaces de crear formas resonantes.
Estructuralmente, dentro del anillo los átomos de carbono están unidos por un enlace sp2 entre ellos y con el orbital s del hidrógeno, quedando un orbital p perpendicular al plano del anillo y que forma con el resto de orbitales p de los otros átomos un enlace π por encima y por debajo del anillo.
Grupo arilo
El grupo funcional arilo (símbolo: Ar) es el sustituyente derivado de un hidrocarburo aromático al extraérsele un átomo de hidrógeno del anillo aromático. El grupo arilo genérico sería el equivalente al grupo alquilogenérico (R). El grupo fenilo (simbolizado Ph o φ) es el grupo arilo más sencillo. Los hidrocarburos que no contienen anillos bencénicos se clasifican como compuestos alifáticos.
Reacciones
Químicamente son por regla general bastante inertes a la sustitución electrófila y a la hidrogenación, reacciones que deben llevarse a cabo con ayuda de catalizadores. Esta estabilidad es debida a la presencia de orbitales degenerados (comparando estas moléculas con sus análogos alifáticos) que conllevan una disminución general de la energía total de la molécula.
-
- φ-H + HNO3 → φ-NO2 + H2O
- φ-H + H2SO4 → φ-SO3H + H2O
- φ-H + Br2 + Fe → φ-Br + HBr + Fe
- Reacción Friedel-Crafts, otro tipo de sustitución electrofílica:
-
- φ-H + RCl + AlCl3 → φ-R + HCl + AlCl3
Otras reacciones de compuestos aromáticos incluyen sustituciones de grupos fenilos.
Aplicación
Entre los arenos más importantes se encuentran todas las hormonas y vitaminas, excepto la vitamina C; prácticamente todos los condimentos, perfumes y tintes orgánicos, tanto sintéticos como naturales; los alcaloides que no son alicíclicos (ciertas bases alifáticas como la putrescina a veces se clasifican incorrectamente como alcaloides), y sustancias como eltrinitrotolueno (TNT) y los gases lacrimógenos. Por otra parte los hidrocarburos aromáticos suelen ser nocivos para lasalud, como los llamados BTEX, benceno, tolueno, etilbenceno y xileno por estar implicados en numerosos tipos de cáncero el alfa-benzopireno que se encuentra en el humo del tabaco, extremadamente carcinógenico igualmente, ya que puede producir cáncer de pulmón.
Toxicología
Los hidrocarburos aromáticos pueden ser cancerígenos. Se clasifican como 2A o 2B.
El efecto principal de la exposición de larga duración (365 días o más) al benceno es en la sangre y los residuos fecales. El benceno produce efectos nocivos en la médula de los huesos y puede causar una disminución en el número de glóbulos rojos, lo que conduce a anemia. El benceno también puede producir hemorragias y daño al sistema inmunitario, aumentando así las posibilidades de contraer infecciones.
Algunas mujeres que respiraron altos niveles de benceno por varios meses tuvieron menstruaciones irregulares y el tamaño de sus ovarios disminuyó. Estudios en animales que respiraron benceno durante la preñez han descrito bajo peso de nacimiento, retardo en la formación de hueso y daño en la médula de los huesos. No se sabe si la exposición al benceno afecta al feto durante el embarazo o a la fertilidad en los hombres.
En el organismo, el benceno es convertido en productos llamados metabolitos. Ciertos metabolitos pueden medirse en la orina. Sin embargo, este examen debe hacerse con prontitud después de la exposición y su resultado no indica con confianza a cuánto benceno estuvo expuesto, ya que los metabolitos en la orina pueden originarse de otras fuentes.
El benceno ha producido intoxicaciones agudas y crónicas en su obtención y en sus múltiples aplicaciones en la industria química. A causa de su elevada toxicidad, en cuantos casos es posible se sustituye por bencina y otros solventes menos tóxicos.
El benceno actúa produciendo irritación local bastante intensa, actúa como narcótico y tóxico nervioso. Su acción crónica se ejerce especialmente como veneno hemático.
Ingerido por error ha producido gastritis. Se ha alcanzado la muerte por ingestión de 30g del líquido.
Se ha determinado que el benceno es un reconocido carcinógeno en seres humanos. La exposición de larga duración a altos niveles de benceno en el aire puede producir leucemia. Cuando se produce la inhalación de vapores concentrados, puede producir rápidamente la narcosis mortal, después de un estado previo de euforia, embriaguez y convulsiones. La inhalación de concentraciones más débiles origina torpeza cerebral, sensación de vértigo, cefalea, náuseas, excitación con humor alegre, embriaguez que puede transformarse en sueño, sacudidas musculares, relajación muscular, pérdida del conocimiento y rigidez pupilar. En caso de intoxicación aguda, se produce enrojecimiento de la cara y las mucosas.
Nomenclaturas
Monosustituidos
- Se conocen muchos derivados de sustitución del benceno. Cuando se trata de los compuestos monosustituidos, las posiciones en el anillo bencénico son equivalentes. Los sustituyentes pueden ser: alquenilos, alquilos , arilos.
- Nombrar el sustituyente antes de la palabra benceno.
Nota: Algunos compuestos tienen nombres tradicionales aceptados.
Disustituidos
- orto- (o-): Se utilizan en carbonos adyacentes. Posiciones 1,2.
- meta- (m-): Se utiliza cuando la posición de los carbonos son alternados. Posiciones 1,3.
- para- (p-): Se utiliza cuando la posición de los sustituyentes están en carbonos opuestos. Posiciones 1,4.
benceno sus posiciones se deben indicar mediante el uso de números, la numeración del anillo debe ser de modo que los sustituyentes tengan el menor número de posición; cuando hay varios sustituyentes se nombran en orden alfabético.§Polisustituidos
- Cuando alguno de los sustituyentes genera un nuevo nombre con el anillo, este pasa a ser el nombre padre y se considera a dicho sustituyente en la posición uno (Ej: 1-amina-2-yodo benceno / 2-yodo anilina / orto-yodo anilina).
benceno como sustituyente se nombra fenilo.§Benceno como radical
- Cuando está unido a una cadena principal es un fenil.
Aromáticos Policíclicos
- Para nombrar a este tipo de compuestos se indica el número de posición de los sustituyentes, seguido del nombre del sustituyente y seguido del nombre del compuesto.
- El orden de numeración de estos compuestos es estricta, no se puede alterar y por ende tienen nombres específicos.
Compuesto heterocíclico
Los compuestos heterocíclicos son compuestos orgánicos cíclicos en los que al menos uno de los componentes del ciclo es de un elemento diferente al carbono. Los átomos distintos de carbono presentes en el ciclo se denominanheteroátomos, siendo más comunes los heteroátomos de nitrógeno, oxígeno y azufre. Ya que presentan cada una de los aminoácidos presentes.
Clasificación[editar]
Tomando como criterio de clasificación la cantidad de insaturaciones de los ciclos; los heterociclos pueden ser saturados o insaturados. Los heterocíclicos insaturados pueden ser aromáticos o no aromáticos.
| Heterociclos |
| ||||||||||||
Compuesto organometálico
Un compuesto organometálico es un compuesto en el que los átomos de carbono de un ligando orgánico forman enlaces covalentescon un átomo metálico. Los compuestos basados en cadenas y anillos de átomos de carbono se llaman orgánicos, y éste es el fundamento del nombre organometálicos. La característica de estos compuestos es la presencia de enlaces entre átomos de metal y de carbono (que pueden ser sencillos, dobles o triples) y por tanto no se consideran organometálicos aquellos compuestos en que un metal se une a una molécula o fragmento por un átomo distinto del carbono, como ocurre en algunos compuestos de coordinación. Este grupo incluye un elevado número de compuestos y algunos químicos lo consideran un grupo distinto al de los compuestos orgánicos e inorgánicos.
Formalmente, los compuestos organometálicos son aquellos que poseen, de forma directa, enlaces entre átomos de metal (o metaloides) y átomos de carbono, M+δ–C-δ, de mayor o menor polaridad.1 Es decir, un compuesto es considerado como organometálico si este contiene al menos un enlace carbono-metal. En este contexto el sufijo “metálico” es interpretado ampliamente para incluir tanto a algunos no metales (como elfósforo) y metaloides tales como B, Si y As así como a metales verdaderos. Esto es debido a que en muchos casos la química de los elementos B, Si, P y As se asemeja a la química de los metales homólogos respectivos. Por lo tanto, el término de compuestos organometálicos es también usado ocasionalmente para incluir dentro a los ya mencionados no metales y semimetales. En todos los casos se trata de elementos menos electronegativos que el carbono.
Tipo de enlace y estabilidad de los compuestos organometálicos
Además del enlace metal-carbono, el metal puede estar unido a otros ligandos formando unidades metal-ligando. El tipo de enlace fundamental entre el carbono y el metal es de tipo covalente, pero también existen compuestos con enlace de dos centros y dos electrones. Además, en los compuestos organometálicos con metales de transición es importante considerar la regla de los 18 electrones.
Hasta 1940 no se pudieron sintetizar muchos organometálicos por lo que se suponía que el enlace carbono-metal era poco estable. En realidad, no es una causa termidinámica la causante de la dificultad de su síntesis, sino un problema cinético que hace necesario inhibir las reacciones de descomposición de los compuestos formados.2 No obstante, la estabilidad termodinámica decrece con el tamaño del metal.
Al aumentar la temperatura, se descomponen muchos de ellos, pero a veces son reacciones lentas por lo que es posible sintetizar estos compuestos.1 En general son poco estables frente a la oxidación y la hidrólisis pues en ambos casos se obtienen productos de gran estabilidad.
Son muy variados los métodos de síntesis:Síntesis de compuestos organometálicos
- Reacciones entre un metal y un haluro orgánico
- Reacciones de intercambio metálico, entre un metal y un compuesto organometálico de otro metal.
- Reacciones de un compuesto organometálico con un haluro metálico.
- Reacciones de inserción:
- Inserción de olefinas y acetilenos en enlaces metal-hidrógeno para metales de los grupos 13 y 14.
- Reacciones de inserción para formación de enlaces metal-carbono para metales de otros grupos.
- Reacciones de compuestos diazo.
- Reacciones de decarboxilación de sales metálicas.
- Reacciones de formación de organometálicos de mercurio y taliocon compuestos aromáticos.
- Reacciones de formación de organometálicos de mercurio con olefinas y acetilenos.
Tipos de compuestos organometálicos
Se pueden establecer diferentes clasificaciones.
Según el enlace metal-carbono
Si consideramos el carácter del enlace entre el metal (o semimetal) y el carbono tendremos:
- Iónicos (no moleculares): Compuestos organometálicos de sodio, potasio, rubidio, cesio, calcio, estroncio, bario ylantánidos.
- Intermedios: Compuestos organometálicos de litio, berilio, magnesio y aluminio. Tienen déficit de electrones y tendencia a formar puentes alquilo y enlaces multicentrados.
- Según el tipo de ligandoCovalentes (moleculares): Compuestos organometálicos de boro, silicio y de elementos de los grupos 12 al 16 que estén por debajo del tercer período, como el Zn, Cd, Hg, Ga, In, Tl, Ge, Sn, Pb, As, Sb, Bi, Se, Te y Po.
- Complejos: Compuestos organometálicos de metales de transición de los grupos 3 a 11, en los que abundan los enlaces tipo pi (π).
- Ligandos que se unen al metal a través de un sólo átomo de carbono.
- Alquilos y ligandos relacionados : el enlace metal-carbono, M-C, es sencillo.
- Alquenilos y acilos: el enlace metal-carbono, M-C, es doble.
- Alquinilos y cianuros: el enlace metal-carbono, M-C, es triple.
- Ligandos que se unen al metal a través de varios átomos de carbono.
El número de átomos de carbono unidos directamente al metal se simboliza con ηn, que se lee n-hapto.
Según el grupo al que pertenece el metal o metaloide
- Compuestos organometálicos del grupo 1:
- Compuestos de organolitio.
- Organilos de otros metales alcalinos: compuestos de organosodio, organopotasio, organorubidio y organocesio.
- Compuestos organometálicos del Grupo 13:Compuestos organometálicos de los grupos 2 y 12:
- Compuestos organometálicos del grupo 2:
- Compuestos de organoberilio.
- Compuestos de organomagnesio.
- Compuestos organometálicos de calcio, estroncio y bario.
- Compuestos organometálicos del grupo 12:
- Compuestos de organozinc.
- Compuestos de organocadmio.
- Compuestos de organomercurio.
- Compuestos organometálicos del grupo 2:
- Compuestos de organoboro.
- Compuestos de organoaluminio.
- Compuestos organometálicos de Galio, Indio y Talio:
- Organilos σ de Ga, In y Tl y sus aductos.
- Complejos π de Ga, In y Tl.
- Compuestos organometálicos del Grupo 14:
- Compuestos de organosilicio: organilos, metilclorosilanos y siliconas.
- Compuestos de organogermanio.
- Compuestos de organoestaño.
- Compuestos de organoplomo.
- Compuestos organometálicos del Grupo 15: organilos de Arsénico, Antimonio y Bismuto.
- Compuestos organometálicos de lantánidos y actínidosCompuestos organometálicos de los metales de transición.
- Con ligandos dadores σ.
- Con ligandos dadores σ / aceptores π.
- Con ligandos dadores σ, π /aceptores π.
- Complejos olefínicos: homoalquenos y heteroalquenos.
- Complejos alquinos: homoalquinos y heteroalquinos.
- Complejos alilos y enilos. Complejos dienilos y trienilos. Complejos ciclopentadienilos binarios.
- Complejos bis arenos metálicos.
Aplicaciones de los complejos organometálicos.
Reacciones catalíticas.Cada día son más abundantes las aplicaciones industriales y de laboratorio de estos complejos. Entre otros usos, se pueden citar:
- Reacciones de isomerización deolefinas.
- Reacciones de arilación y vinilación (reacción de Heck).
- Metátesis de alquenos.
- Reacciones de oligomerización y polimerización.
- Oxidación de olefinas (Proceso Wacker).
- Hidrogenación de alquenos.
- Reacciones de Fischer-Tropsch.
- Reacción de desplazamiento del gas de agua.
- Proceso Monsanto para la síntesis del ácido acético.
- Hidroformilación de olefinas (Proceso oxo).
- Hidrocianación de olefinas.
- Carbonilación de olefinas (Reacción de Reppe).
- Activación de enlaces C-H en alcanos.
Polímero
Los polímeros (del griego poly: «muchos» y mero: «parte», «segmento») son macromoléculas (generalmente orgánicas) formadas por la unión de moléculas más pequeñas llamadasmonómeros.
El almidón, la celulosa, la seda y el ADN son ejemplos de polímeros naturales, entre los más comunes de estos y entre los polímeros sintéticos encontramos el nailon, el polietileno y la baquelita.
Polimerización
La reacción por la cual se sintetiza un polímero a partir de sus monómeros se denomina polimerización. Según el mecanismo por el cual se produce la reacción de polimerización para dar lugar al polímero, esta se clasifica como "polimerización por pasos" o como "polimerización en cadena". En cualquier caso, el tamaño de la cadena dependerá de parámetros como la temperatura o el tiempo de reacción, teniendo cada cadena un tamaño distinto y, por tanto, una masa molecular distinta, de ahí que se hable de masa promedio del polímero.
Tipos de polimerización
Existen dos tipos fundamentales de polimerización:
En cada unión de dos monómeros se pierde una molécula pequeña, por ejemplo agua. Debido a esto, la masa molecular del polímero no es necesariamente un múltiplo exacto de la masa molecular del monómero. Los polímeros de condensación se dividen en dos grupos:
- Los Homopolímeros.
- Los Copolímeros.
La polimerización en etapas (condensación) necesita al menos monómeros bifuncionales. Deben de saber que los polímeros pueden ser maquinables.
Ejemplo: HOOC--R1--NH2
Si reacciona consigo mismo, entonces:
2 HOOC--R1--NH2 <----> HOOC--R1--NH· + ·OC--R1--NH2 + H2O <----> HOOC--R1-NH--CO--R1--NH2 + H2O
En este tipo de polimerización la masa molecular del polímero es un múltiplo exacto de la masa molecular del monómero.
Suelen seguir un mecanismo en tres fases, con ruptura hemolítica:
-
- Iniciación: CH2=CHCl + catalizador ⇒ •CH2–CHCl•
- Propagación o crecimiento: 2 •CH2–CHCl• ⇒ •CH2–CHCl–CH2–CHCl•
- Terminación: Los radicales libres de los extremos se unen a impurezas o bien se unen dos cadenas con un terminal neutralizado.
Polimerización del estireno para dar poliestireno
n indica el grado de polimerización
n indica el grado de polimerización
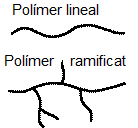
Por otra parte, los polímeros pueden ser lineales, formados por una única cadena de monómeros, o bien esta cadena puede presentar ramificaciones de mayor o menor tamaño. También se pueden formar entrecruzamientos provocados por el enlace entre átomos de distintas cadenas.
La naturaleza química de los monómeros, su masa molecular y otras propiedades físicas, así como la estructura que presentan, determinan diferentes características para cada polímero. Por ejemplo, si un polímero presenta entrecruzamiento, el material será más difícil de fundir que si no presentara ninguno.
Los enlaces de carbono en los polímeros no son equivalentes entre sí, por eso dependiendo del orden estereoquímico de los enlaces, un polímero puede ser: atáctico (sin orden), isotáctico (mismo orden), o sindiotáctico (orden alternante) a esta conformación se la llama tacticidad. Las propiedades de un polímero pueden verse modificadas severamente dependiendo de suestereoquímica.
En el caso de que el polímero provenga de un único tipo de monómero se denominahomopolímero y si proviene de varios monómeros se llama copolímero o heteropolímero. Por ejemplo, el poliestireno es un homopolímero, pues proviene de un único tipo de monómero, el estireno, mientras que si se parte de estireno y acrilonitrilo se puede obtener un copolímero de estos dos monómeros.
En los heteropolímeros los monómeros pueden distribuirse de diferentes maneras, particularmente para polímeros naturales, los monómeros pueden repetirse de forma aleatoria, informativa (como en los polipéptidos de las proteínas o en los polinucleótidos de los ácidos nucleicos) o periódica, como en el peptidoglucano o en algunos polisacáridos.
Los monómeros que conforman la cadena de un copolímero se pueden ubicar en la cadena principal alternándose según diversos patrones, denominándose copolímero alternante, copolímero en bloque, copolímero aleatorio, copolímero de injerto. Para lograr este diseño, la reacción de polimerización y los catalizadores deben ser los adecuados.

a) Homopolímero b) Copolímero alternante
c) Copolímero en bloque d) Copolímero aleatorio
e) Copolímero de injerto
c) Copolímero en bloque d) Copolímero aleatorio
e) Copolímero de injerto
Finalmente, los extremos de los polímeros pueden ser distintos que el resto de la cadena polimérica, sin embargo es mucho más importante el resto de la cadena que estos extremos debido a que la cadena es de una gran extensión comparada con los extremos.
Propiedades
Propiedades eléctricas
Los polímeros industriales en general suelen ser malos conductores eléctricos, por lo que se emplean masivamente en la industria eléctrica y electrónica como materiales aislantes. Las baquelitas (resinas fenólicas) sustituyeron con ventaja a lasporcelanas y el vidrio en el aparellaje de baja tensión hace ya muchos años; termoplásticos como el PVC y los PE, entre otros, se utilizan en la fabricación de cables eléctricos, llegando en la actualidad a tensiones de aplicación superiores a los 20 KV, y casi todas las carcasas de los equipos electrónicos se construyen en termoplásticos de magníficas propiedades mecánicas, además de eléctricas y de gran duración y resistencia al medio ambiente, como son, por ejemplo, las resinas ABS.
Para evitar cargas estáticas en aplicaciones que lo requieran, se ha generalizado el uso de antiestáticos que permite en la superficie del polímero una conducción parcial de cargas eléctricas.
Evidentemente la principal desventaja de los materiales plásticos en estas aplicaciones está en relación a la pérdida de características mecánicas y geométricas con la temperatura. Sin embargo, ya se dispone de materiales que resisten sin problemas temperaturas relativamente elevadas (superiores a los 200 °C).
Las propiedades eléctricas de los polímeros industriales están determinadas principalmente, por la naturaleza química del material (enlaces covalentes de mayor o menor polaridad) y son poco sensibles a la microestructura cristalina o amorfa del material, que afecta mucho más a las propiedades mecánicas. Su estudio se acomete mediante ensayos de comportamiento en campos eléctricos de distinta intensidad y frecuencia. Seguidamente se analizan las características eléctricas de estos materiales.
Los polímeros conductores fueron desarrollados en 1974 y sus aplicaciones aún están siendo estudiadas.
Propiedades físicas de los polímeros.
Estudios de difracción de rayos X sobre muestras de polietileno comercial, muestran que este material, constituido pormoléculas que pueden contener desde 1.000 hasta 150.000 grupos CH2 – CH2 presentan regiones con un cierto ordenamiento cristalino, y otras donde se evidencia un carácter amorfo: a éstas últimas se les considera defectos del cristal. En este caso las fuerzas responsables del ordenamiento cuasicristalino, son las llamadas fuerzas de van der Waals. En otros casos (nylon 66) la responsabilidad del ordenamiento recae en los enlaces de H.
La temperatura tiene mucha importancia en relación al comportamiento de los polímeros. A temperaturas más bajas los polímeros se vuelven más duros y con ciertas características vítreas, debido a la pérdida de movimiento relativo entre las cadenas que forman el material. La temperatura a la que funden las zonas cristalinas se llama temperatura de fusión (Tf). Otra temperatura importante es la de descomposición y es conveniente que sea bastante superior a Tf.
Las propiedades mecánicas
Son una consecuencia directa de su composición, así como de la estructura molecular, tanto a nivel molecular como supermolecular. Actualmente las propiedades mecánicas de interés son las de los materiales polímeros y éstas han de ser mejoradas mediante la modificación de la composición o morfología: por ejemplo, cambiar la temperatura a la que los polímeros se ablandan y recuperan el estado de sólido elástico o también el grado global del orden tridimensional. Normalmente el incentivo de estudios sobre las propiedades mecánicas es generalmente debido a la necesidad de correlacionar la respuesta de diferentes materiales bajo un rango de condiciones con objeto de predecir el comportamiento de estos polímeros en aplicaciones prácticas.
Durante mucho tiempo los ensayos han sido realizados para comprender el comportamiento mecánico de los materiales plásticos a través de la deformación de la red de polímeros reticulados y cadenas moleculares enredadas, pero los esfuerzos para describir la deformación de otros polímeros sólidos en términos de procesos operando a escala molecular son más recientes. Por lo tanto, se considerarán los diferentes tipos de respuesta mostrados por los polímeros sólidos a diferentes niveles de tensión aplicados; elasticidad, viscoelasticidad, flujo plástico y fractura.
Clasificación
Existen varias formas posibles de clasificar los polímeros, sin que sean excluyentes entre sí.
Según su origen
- Polímeros naturales. Existen en la naturaleza muchos polímeros y las biomoléculas que forman los seres vivos sonmacromoléculas poliméricas. Por ejemplo, las proteínas, los ácidos nucleicos, los polisacáridos (como la celulosa y laquitina), el hule o caucho natural, la lignina, etc.
- Polímeros semisintéticos. Se obtienen por transformación de polímeros naturales. Por ejemplo, la nitrocelulosa, el caucho vulcanizado, etc.
- Polímeros sintéticos. Muchos polímeros se obtienen industrialmente a partir de los monómeros. Por ejemplo, elnailon, el poliestireno, el Policloruro de vinilo (PVC), el polietileno, etc.
Según su mecanismo de polimerización
En 1929 Carothers propuso la siguiente clasificación:
- Polímeros de condensación. La reacción de polimerización implica a cada paso la formación de una molécula de baja masa molecular, por ejemplo agua.
- Polímeros de adición. La polimerización no implica la liberación de ningún compuesto de baja masa molecular.Esta polimerización se genera cuando un "catalizador", inicia la reacción. Este catalizador separa la unión doble carbono en los monómeros, luego aquellos monómeros se unen con otros debido a los electrones libres, y así se van uniendo uno tras uno hasta que la reacción termina.
Clasificación de Flory (modificación a la de Carothers para considerar la cinética de la reacción):
- Polímeros formados por reacción en cadena. Se requiere un iniciador para comenzar la polimerización; un ejemplo es la polimerización de alquenos (de tipo radicalario). En este caso el iniciador reacciona con una molécula de monómero, dando lugar a un radical libre, que reacciona con otro monómero y así sucesivamente. La concentración de monómero disminuye lentamente. Además de la polimerización de alquenos, incluye también polimerización donde las cadenas reactivas son iones (polimerización catiónica y aniónica).
- Polímeros formados por reacción por etapas. El peso molecular del polímero crece a lo largo del tiempo de manera lenta, por etapas. Ello es debido a que el monómero desaparece rápidamente, pero no da inmediatamente un polímero de peso molecular elevado, sino una distribución entre dímeros, trímeros, y en general, oligómeros; transcurrido un cierto tiempo, estos oligómeros empiezan a reaccionar entre sí, dando lugar a especies de tipo polimérico. Esta categoría incluye todos los polímeros de condensación de Carothers y además algunos otros que no liberan moléculas pequeñas pero sí se forman gradualmente, como por ejemplo los poliuretanos.
Según su composición química
- Polímeros orgánicos. Posee en la cadena principal átomos de carbono.
- Polímeros orgánicos vinílicos. La cadena principal de sus moléculas está formada exclusivamente por átomos decarbono.
- Dentro de ellos se pueden distinguir:
- Poliolefinas, formados mediante la polimerización de olefinas.
- Ejemplos: polietileno y polipropileno.
- Polímeros estirénicos, que incluyen al estireno entre sus monómeros.
- Ejemplos: poliestireno y caucho estireno-butadieno.
- Polímeros vinílicos halogenados, que incluyen átomos de halógenos (cloro, flúor...) en su composición.
- Polímeros acrílicos. Ejemplos: PMMA.
- Polímeros orgánicos no vinílicos. Además de carbono, tienen átomos de oxígeno o nitrógeno en su cadena principal.
- Algunas sub-categorías de importancia:
- Polímeros inorgánicos. Entre otros:
- Basados en azufre. Ejemplo: polisulfuros.
- Basados en silicio. Ejemplo: silicona.
Según sus aplicaciones
Atendiendo a sus propiedades y usos finales, los polímeros pueden clasificarse en:
- Elastómeros. Son materiales con muy bajo módulo de elasticidad y alta extensibilidad; es decir, se deforman mucho al someterlos a un esfuerzo pero recuperan su forma inicial al eliminar el esfuerzo. En cada ciclo de extensión y contracción los elastómeros absorben energía, una propiedad denominada resiliencia.
- Plásticos. Son aquellos polímeros que, ante un esfuerzo suficientemente intenso, se deforman irreversiblemente, no pudiendo volver a su forma original. Hay que resaltar que el término plástico se aplica a veces incorrectamente para referirse a la totalidad de los polímeros.
- Fibras. Presentan alto módulo de elasticidad y baja extensibilidad, lo que permite confeccionar tejidos cuyas dimensiones permanecen estables.
- Recubrimientos. Son sustancias, normalmente líquidas, que se adhieren a la superficie de otros materiales para otorgarles alguna propiedad, por ejemplo resistencia a la abrasión.
- Adhesivos. Son sustancias que combinan una alta adhesión y una alta cohesión, lo que les permite unir dos o más cuerpos por contacto superficial.
Según su comportamiento al elevar su temperatura
Para clasificar polímeros, una de las formas empíricas más sencillas consiste en calentarlos por encima de cierta temperatura. Según si el material funde y fluye o por el contrario no lo hace se diferencian tres tipos de polímeros:
- Termoplásticos, que fluyen (pasan al estado líquido) al calentarlos y se vuelven a endurecer (vuelven al estado sólido) al enfriarlos. Su estructura molecular presenta pocos (o ningún) entrecruzamientos. Ejemplos: polietileno (PE),polipropileno (PP), cloruro de polivinilo PVC.
- Termoestables, que no fluyen, y lo único que conseguimos al calentarlos es que se descompongan químicamente, en vez de fluir. Este comportamiento se debe a una estructura con muchos entrecruzamientos, que impiden los desplazamientos relativos de las moléculas.
- Elastómero, plásticos con un comportamiento elástico que pueden ser deformados fácilmente sin que se rompan sus enlaces o modifique su estructura.
La clasificación termoplásticos / termoestables es independiente de la clasificación elastómeros / plásticos / fibras. Existen plásticos que presentan un comportamiento termoplástico y otros que se comportan como termoestables. Esto constituye de hecho la principal subdivisión del grupo de los plásticos y hace que a menudo cuando se habla de "los termoestables" en realidad se haga referencia solo a "los plásticos termoestables". Pero ello no debe hacer olvidar que los elastómeros también se dividen en termoestables (la gran mayoría) y termoplásticos (una minoría pero con aplicaciones muy interesantes).
Nomenclatura
A parte de las reglas de nomenclatura establecidas por la IUPAC, existe otro mecanismo alternativo con el que también se pueden nombrar los polímeros y es tomando como base el monómero del cual son provenientes. Este sistema es el más común. Entre los compuestos nombrados de esta manera se encuentran: el polietileno y el poliestireno. Se tiene que cuando el nombre del monómero es de una sola palabra, el polímero constituido a partir de este sencillamente se nombra agregando el prefijo poli.
Las normas internacionales publicadas por la IUPAC indican que el principio general para nombrar polímeros básicos es utilizar el prefijo poli- seguido de la unidad estructural repetitiva (UER) que define al polímero, escrita entre paréntesis. La UER debe ser nombrada siguiendo las normas convencionales de la IUPAC para moléculas sencillas.1
| Poli (tio-1,4-fenileno) |
Las normas IUPAC se utilizan habitualmente para nombrar los polímeros de estructura complicada, ya que permiten identificarlos sin ambigüedad en las bases de datos de artículos científicos.2 Por el contrario, no suelen ser utilizadas para los polímeros de estructura más sencilla y de uso común principalmente porque estos polímeros fueron inventados antes de que se publicasen las primeras normas IUPAC, en 1952, y por tanto sus nombres "comunes" o "tradicionales" ya se habían popularizado.
En la práctica, los polímeros de uso común se suelen nombrar según alguna de las siguientes opciones:
- Prefijo poli- seguido del monómero del que se obtiene el polímero. Esta convención es diferente de la IUPAC porque el monómero no siempre coincide con la UER y además se nombra sin paréntesis y en muchos casos según una nomenclatura "tradicional", no la IUPAC. Ejemplos: polietileno frente a poli (metileno); poliestireno frente a poli(1-feniletileno)
Para copolímeros se suelen listar simplemente los monómeros que los forman, a veces precedidos de las palabrascaucho o goma si se trata de un elastómero o bien resina si es un plástico. Ejemplos: acrilonitrilo butadieno estireno;caucho estireno-butadieno; resina fenol-formaldehído.
- Es frecuente también el uso indebido de marcas comerciales como sinónimos del polímero, independientemente de la empresa que lo fabrique. Ejemplos: Nailon para poliamida; Teflon para politetrafluoretileno; Neopreno parapolicloropreno.
La IUPAC reconoce que los nombres tradicionales están firmemente asentados por su uso y no pretende abolirlos sino solo ir reduciendo paulatinamente su utilización en las publicaciones científicas.1
Historia
Los polímeros son muy grandes sumas de moléculas, con masas moleculares que puede alcanzar incluso los millones de UMAs que se obtienen por la repeticiones de una o más unidades simples llamadas “monómeros” unidas entre sí mediante enlaces covalentes. Estos forman largas cadenas que se unen entre sí por fuerzas de Van der Waals, puentes de hidrógeno o interacciones hidrofóbicas.
El desarrollo de los polímeros fue inducido a través de las modificaciones de estos con el fin de mejorar sus propiedades físicas en pro del auge de las aplicaciones de los mismos. En 1839, Charles Goodyear modificó el hule a través del calentamiento con azufre (vulcanización), ya que este por lo general era frágil en temperaturas bajas y pegajoso a altas temperaturas.
Mediante la vulcanización el hule se convirtió en una sustancia resistente a un amplio margen de temperaturas. Otro acontecimiento que contribuyó al desarrollo continuo de los polímeros fue la modificación de la celulosa que permitió el surgimiento de las fibras sintéticas llamadas rayones. Posteriormente Leo Baekeland instauró el primer polímero totalmente sintético al que llamó baquelita; este se caracterizó por ser un material muy duradero y por provenir de otros materiales de bajo costo como el fenol y el formaldehído. Este compuesto llegó a tener gran éxito durante cierto tiempo. Sin embargo independientemente de los avances aplicativos de los polímeros, no se tenía mucha información en cuanto a la estructura de estos.
En el transcurso de la década de 1920, Herman Staudinger fue el primero en instituir que los polímeros eran compuestos de gran peso molecular que se encontraban unidos mediante la formación de enlaces covalentes. Tal idea fue apoyada años más tarde por Wallace Carothers, de DuPont, los cuales llegaron a establecer concepciones similares. Estos conceptos dieron paso al desarrollo de la química de los polímeros tanto sintéticos como naturales.
Los polímeros naturales, por ejemplo la lana, la seda, la celulosa, etc., se han empleado profusamente y han tenido mucha importancia a lo largo de la historia. Sin embargo, hasta finales del siglo XIX no aparecieron los primeros polímeros sintéticos, como por ejemplo el celuloide.
Los primeros polímeros que se sintetizaron se obtenían a través de transformaciones de polímeros naturales. En 1839Charles Goodyear realiza el vulcanizado del caucho. El nitrato de celulosa se sintetizó accidentalmente en el año 1846 por el químico Christian Friedrich Schönbein y en 1868, John W. Hyatt sintetizó el celuloide a partir de nitrato de celulosa.
El primer polímero totalmente sintético se obtuvo en 1907,3 cuando el químico belga Leo Hendrik Baekeland fabrica labaquelita a partir de formaldehído y fenol. Otros polímeros importantes se sintetizaron en años siguientes, por ejemplo el poliestireno (PS) en 1911 o el poli (cloruro de vinilo) (PVC) en 1912.
En 1922, el químico alemán Hermann Staudinger comienza a estudiar los polímeros y en 1926 expone su hipótesis de que se trata de largas cadenas de unidades pequeñas unidas por enlaces covalentes. Propuso las fórmulas estructurales del poliestireno y del polioximetileno, tal como las conocemos actualmente, como cadenas moleculares gigantes, formadas por la asociación mediante enlace covalente de ciertos grupos atómicos llamados "unidades estructurales". Este concepto se convirtió en "fundamento" de la química macromolecular solo a partir de 1930, cuando fue aceptado ampliamente. En 1953 recibió el Premio Nobel de Química por su trabajo.
Wallace Carothers, trabajando en la empresa DuPont desde 1928, desarrolló un gran número de nuevos polímeros:poliésteres, poliamidas, neopreno, etc.
La Segunda Guerra Mundial contribuyó al avance en la investigación de polímeros. Por ejemplo, fue muy importante la sustitución del caucho natural por caucho sintético.
En los años 1950 el alemán Karl Ziegler y el italiano Giulio Natta desarrollaron los catalizadores de Ziegler-Natta y obtuvieron el Premio Nobel de Química en 1963.
Otro Premio Nobel de Química fue concedido por sus estudios de polímeros a Paul J. Flory en 1974.
En la segunda mitad del siglo XX se desarrollaron nuevos métodos de obtención, polímeros y aplicaciones. Por ejemplo,catalizadores metalocénicos, fibras de alta resistencia, polímeros conductores (en 2000 Alan J. Heeger, Alan G. MacDiarmid y Hideki Shirakawa recibieron el Premio Nobel de Química por el desarrollo de estos polímeros), estructuras complejas de polímeros, polímeros cristales líquidos, etc.

No hay comentarios.:
Publicar un comentario